BLADMOSER: INNDELING, BYGNING OG EVOLUSJON
Forskjeller mellom underklassene
Bladmoser
(i vid forstand) omfatter tre underklasser (Tabell 1). To av disse (Sphagnidae og Andreaeidae) har bare ei slekt
hver, mens bortimot 99% av artene finnes i underklasse
Bryidae (bladmoser i snever forstand). Det framgår av skillekarakterene i
Tabell 7 at underklassene er velavgrensete og på mange måter isolerte.
Tabellen viser også at alle par av underklasser har fellesskap i antatt
opprinnelige karakterer som ikke deles av den tredje. Alle underklasser har
dessuten synapomorfier. Torvmosene (underklasse Sphagnidae) synes å være den av
underklassene som har beholdt flest opprinnelige trekk; legg merke til (1) det
thallusformete protonemaet, (2) at kalyptra ikke blir sittende på kapselen som
ei hette, (3) mangelen på parafyser og (4) kuleformete anteridier. Men
torvmosene har også flere opplagt apomorfe trekk; (1) organiseringen av
greinene i knipper, (2) celledifferensieringen, kanskje også (3) enkelte
bygningstrekk i den kompakte kapselen (kort, tappformet
kolumella som utgjør hele endotheciet, arkesporiedannelse fra amfitheciet.
Tabell 7.
Sammenlikning av bladmoseunderklasser.
karakter Sphagnidae Andreaeidae Bryidae
Gametofytt
protonema thalloid komplekst,
med både thalløse båndformet
og
trådformete deler
plassering av greiner i knipper enkeltvis enkeltvis
celledifferensiering alternering mellom kloro- ingen ingen
vesentlig
fyll-
og hyalinceller
bladnerve mangler (finnes i fossile for- kan
finnes kan
finnes
mer
som ellers likner Sphagnum)
arkegonium blir til vaginula ved basis av fot vaginula ved basis av fot + vaginula ved basis av fot +
kalyptra på kapsel kalyptra på kapsel
anteridier kuleformete avlange avlange
parafyser mangler finnes
oftest finnes oftest
Sporofytt
heves av pseudopodium fra pseudopodium fra seta (del av sporofytten)
gametofytten gametofytten
seta redusert redusert finnes
oftest; langlevd, stiv
kapselens åpnings- lokk fire
spalter, fliker forblir festa lokk og
(oftest) peristom
mekanisme i
toppen
kolumella (penetrerer kort, tappformet noe mer avlang, tappformet i hele kapselens lengde endothecium)
arkesporium dannes fra amfithecium endothecium endothecium
Underklasse Andreaeidae
Sotmosene
(Andreaeidae; Figur 15) skiller seg lite fra Bryidae i gametofyttens bygning. De
er, som navnet antyder, små og mørke, dessuten er de opprette og lite forgreina,
Sporofytten er endestilt. Bladene er eggformete eller avlange, kan være
tilspissete. Andreaeidae kan ha felles opphav med Bryidae. Synapomorfier er i så
fall forekomsten av (1) nerve i bladene, (2) parafyser, (3) langstrakte
anteridier, (4) trådformet protonema, (5) kalyptra og (6) sporedannelse fra
endotheciet. Vi vet ikke om reduksjonen av seta (funksjon overtatt av et pseudopodium,
en stilk som utvikler seg fra gametofytten) og en kompakt kapsel representer
felles opprinnelige trekk for torv- og sotmoser eller om disse strukturene er
utviklet uavhengig i de to underklassene, homoplasier. Underklasse Andreaeidae
skiller seg fra underklasse Bryidae i en rekke opprinnelige trekk slike som (1)
den kompakte kapselen uten lokk (lokket hos Sphagnum kan være utviklet
uavhengig av lokket i Bryidae) og uten peristom, og (2) den korte kolumellaen
med hvelvet arkesporium. Kapselens åpningsmekanisme er trolig en unik, avleda
karakter for gruppa. Felles avleda trekk for underklasse Bryidae er (1)
gjennomgående kolumella, (2) peristom, og (3) langlevd seta.
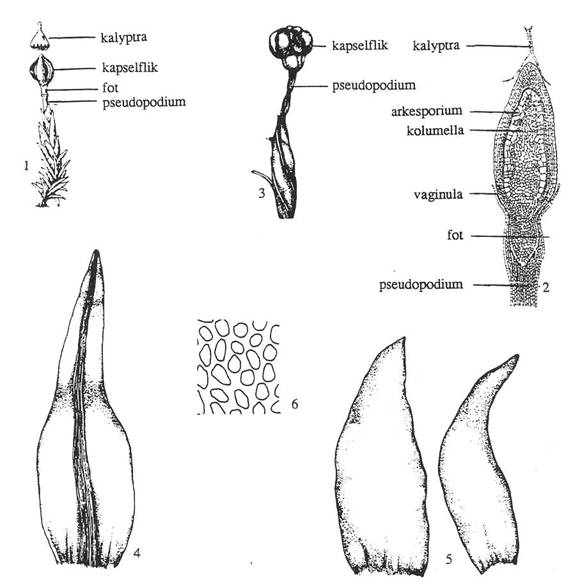
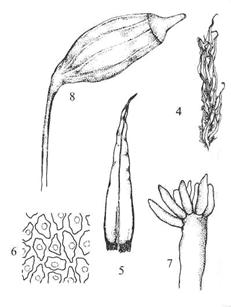
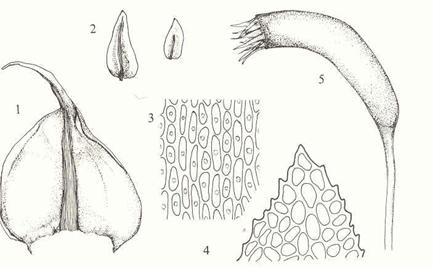
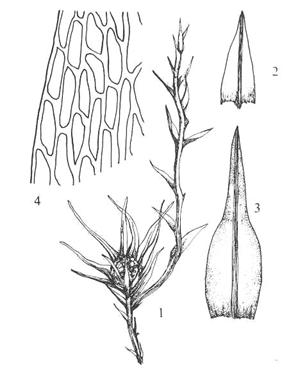
Figur 15. Underklasse Andreaeidae. 1: Hel
plante med sporofytt. 2: Lengdesnitt gjennom ung sporofytt. 3-4: Andreaea
rothii. 3: Moden sporofytt i tørt vær med kapselfliker åpne. 4: Blad med
nerve. 5-6. Andreaea rupestris. 5: Blad uten nerve. 6: Bladceller (fra
midten av bladet). Etter Harder (1976) og Smith (1978).
Underklasse Sphagnidae
Underklassen
er bygningsmessig svært homogen (Figur 16). Torvmosenes økologiske suksess på våre
breddegrader kan ikke forstås uten at man kjenner gametofyttens bygning. Protonema er
grønt og thallusformet og torvmosenes eneste stadium med rhizoider.
Gametofyttens
bygning er unik i forhold til alle andre moser. Den opprette hovedstengelen har
i tverrsnitt ytterst en bark av store, tynnveggete celler (hyalodermis)
som raskt kan ta opp og lagre vann. Hyalodermiscellene kan ha støttelister (fibre)
og/eller åpninger (porer). Disse er diagnostisk viktige karakterer på
artsnivå. Greiner sitter 2-12 sammen i knipper
og er av to typer; utstående og hengende. Oftest er de to greintypene
klart skilt; de hengende er spinklere og har sterkere tiltrykte blader. Ofte er
hengegreinene tiltrykt
stengelen, som en kappe. Greinene har oftest enlaget hyalodermis;
greinhyalodermiscellene kan ha fibre og/eller porer. I toppen av stengelen, der
den aktive veksten skjer, er greinene samlet i et hode.
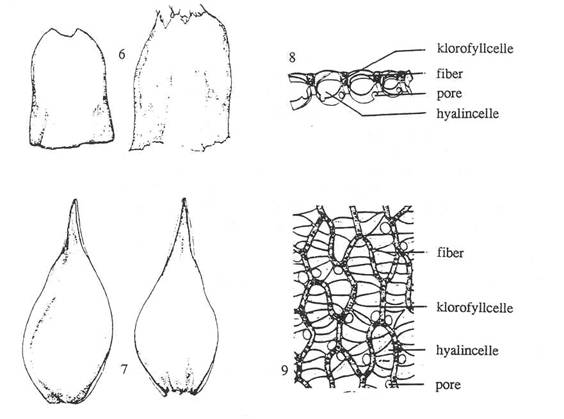
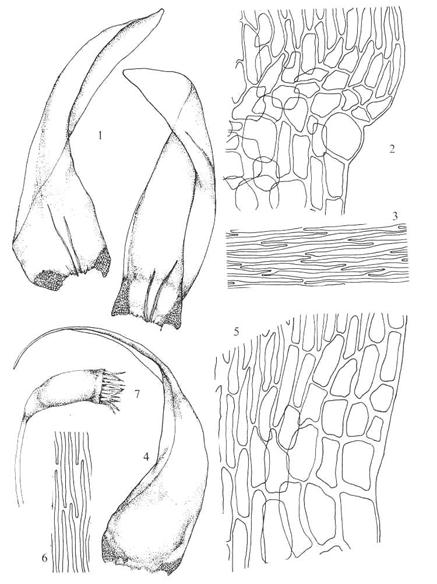
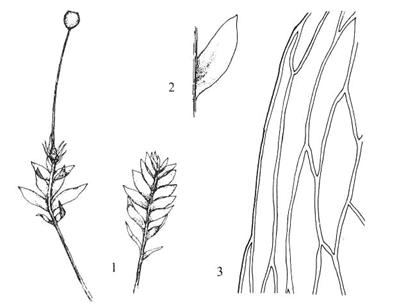
Figur 16. Underklasse Sphagnidae. 1: Sphagnum
fuscum, hel plante. 2: Sphagnum palustre, thallusformet protonema
med flercellete rhizoider. 3: &-grein med ung sporofytt. 4: Lengdesnitt gjennom ung sporofytt
(før arkegonieveggen brister). 5: Sphagnum compactum, tverrsnitt av
stengel. 6-7. Sphagnum girgensohnii. 6: Stengelblad. 7: Greinblad. 8:
Karakteristisk tverrsnitt av greinblad. 9: Karakteristisk cellemønster i
greinblad. Etter Harder (1976), Smith (1978) og Andrus (1980).
Figur 16.
Underklasse Sphagnidae. Figurtekst forige side.
Bladene er av to
typer, stengelblad og greinblad, som skiller seg i form og
størrelse, men som er bygget over et felles grunnplan
med to typer bladceller som alternerer. Tidlig i bladets utvikling
utdifferensieres levende, små klorofyllceller, fra omkringliggende,
store hyalinceller. Hyalincellene, som er døde når bladet er fullt
utviklet, har cellevegger forsterket med fibre og dessuten åpninger mot
omgivelsene (porer) eller celleveggfortynninger (pseudoporer og membranluker)
som letter vannopptak. Andre viktige karakterer ved bestemmelse av
torvmoser, er hodets form og skuddets (og stengelens) farge (pigmentering).
Torvmoser er vanskelige å artsbestemme for
nybegynneren fordi de fleste arter har stor morfologisk variasjon (plastisitet)
langs økologiske gradienter.
Underklasse Bryidae
Underklassen
Bryidae omfatter bortimot 99% av alle
bladmoser. Den holdes sammen av mange fellestrekk i oppbygging av både
gametofytten og sporofytten og er trolig en gruppe med langvarig evolusjon
isolert fra andre mosegrupper. Variasjonen innen gruppen er imidlertid
komplisert og kan være resultat av parallell evolusjon av flere trekk i flere
grupper. Det er derfor ennå ikke mulig å sette opp et entydig stamtre for de
tre ordenene med 15–16 underordener.
Vegetative bygningstrekk
Protonemaet
som dannes når sporen spirer består hos nesten alle Bryidae av et
nettverk av sterkt forgreinete tråder med tverrstilte cellevegger. Bare
unntaksvis (i ordenen Tetraphidales firtannmoser) dannes det avflatete,
thallus-liknende partier på protonema (se figur 23) eller (i underordenen Schistostegineae
lysmose) er hele protonema thalloid og varig. Under ekstreme forhold, f.eks. om
en mose blir utsatt for uvanlig mye skygge eller fuktighet, kan protonema
gjenutvikles fra en voksen gametofytt. Det samme gjelder om en mose blir
fragmentert; fragmenter av voksne gametofytter kan danne protonema og nye fullvoksne
gametofytter. Det synes derfor å være en nokså enkel
fysiologisk ’switch’-mekanisme mellom det relativt lite organiserte
protonemaet og den mer komplisert organiserte voksne gametofytten.
Gametofyttens bygning. Det
er to hovedmønster av forgreining, men med enkelte mellomformer. Hos akrokarpe
moser (f.eks. bjørnemose, sigdmose, nikkemose) er skuddene lite eller ikke
forgreinet og opprette, og kjønnsorganer og sporofytt er endestilte på
skuddene. Hos pleurokarpe moser (f.eks. etasjemose, furumose, tujamose,
klomoser) er skuddene oftest mye forgreinet og nedliggende, og kjønnsorganer og
sporofytt synes å være sidestilte på hovedskuddene (egentlig er de endestilt på
korte sideskudd).
Stengelen
kan ha en mer eller mindre differensiert anatomi. Mest differensiert er den hos
bjørnemosene (Polytrichales) der vi innerst har en sentralsylinder med
to typer spesialiserte ledningsceller: Hydroider er langstrakte, døde
celler som leder vatn og løste næringsstoffer. De har samme funksjon som
trakeider hos karplanter, men er ikke nødvendigvis homologe med disse. Leptoider
er levende celler som likner bindevevet rundt, og som dessuten likner
karplantenes silvevceller. De har trolig en funksjon i transport av organiske
stoffer. Leptoider forekommer bare hos bjørnemosene. Ytterst finner vi en bark
(cortex). I mange mosegrupper er sentralsylinderen dårlig utviklet, og
hos andre mangler den helt.
Bladet
består oftest av bare ett cellelag (viktig unntak i bjørnemosene, Polytrichales,
se også nedafor), bortsett fra i midtnerve-regionen. Bladnerven omfatter stereider
som er svært tjukkveggete celler med støttefunksjon og føreceller som
kan ha en ledningsfunksjon. Førecellene kan være hydroider (men ikke
leptoider). Bladnerven kan fortsette inn i stengelen som et bladspor, i
likhet med hva man finner hos karplanter. Imidlertid er det bare hos noen av
bjørnemosene at bladsporet knytter seg til sentralsylinderen med ledningsvev og
derfor er et ekte bladspor. Hos de andre stopper det litt innafor cortex
og er et såkalt falsk bladspor, med uviss
funksjon. Det er mange mosegrupper hvor bladnerve og bladspor er dårlig
utviklet (mangler ledningsvev), eller hvor de mangler helt.
Hvordan
ledningsvevet i stengel og blad hos Bryidae tolkes har betydning for tolkningen
av disse mosenes evolusjonære plassering. Er ledningsvevet et tidlig trinn i
utviklingen mot det mye mer effektive og utstrakte ledningsvevet hos karplanter
(kar = ledningsvev), eller er det lite eller ikke fungerende rester fra
tidligere former med mer utviklet (og mer effektivt) ledningsvev?
Funksjonaliteten i ledningsvevet hos bjørnemosene støtter den første
tolkningen; falske bladspor, liten funksjonalitet og mangel i store grupper
støtter den andre tolkningen.
Mens
karplanter deles i blad, stengel (og rot), har moser og særlig Bryidae
to innbyrdes beslektete organgrupper som er spesielle: rhizoider (uten
klorofyll) og parafyllier (med klorofyll). Dette er flercellete,
forgrenete trådsystemer som morfologisk likner noe på protonema, men som vokser
ut fra stengel og blad på den voksne gametofytten og som skiller seg
morfologisk fra protonema ved at de har skrå skillevegger mellom cellene i
trådene. Det finnes imidlertid overganger mellom rhizoider/parafyllier og
protonema, noe som tyder på en evolusjonær og utviklingsmessig sammenheng. De
synes å ha tre funksjoner: feste, vannopptak, og som beskyttelse rundt unge
greinanlegg.
I
prinsippet er bladene oftest skruestilte på skuddene fordi den trekantete
apikalcellen vrir seg under skuddets vekst. I mange tilfeller er imidlertid
vridningen så regulær at bladene blir stående i nokså tydelige rekker: fem
rekker hos f.eks. piperensermose Paludella squarrosa, tre tydelige
rekker hos elvemose Fontinalis, og i to rekker hos f.eks. den akrokarpe,
opprette planmosen Distichium complanatum og de pleurokarpe, nedliggende
fellmosene Neckera.
Formen
på bladene, nærvær eller fravær og utviklingsgrad av bladnerve, og formen på
bladcellene er – ved siden av peristomet på sporofytten (se nedafor) – de
viktigste karakterene for gjenkjennelse og systematisk gruppering av Bryidae.
Vi vil komme tilbake til dette under de enkelte ordener og underordener
nedafor, men noen av begrepene vil bli introdusert her. Hos pleurokarpe
(greinete) moser kan det være stor forskjell på stengelblad og greinblad (som
også hos torvmosene Sphagnum). Bladene kan være tydelig skilt fra
stengelen, eller nedre del av bladet kan fortsette nedover langs stengelen
(nedløpenhet). Bladene deles i plate (lamina) og nerve, men de kan være
uten nerve, med en kort dobbelt (eller greinet) nerve, eller ha en mer eller
mindre brei, tydelig nerve. Særlig brei er nerva hos blåmose Leucobryum
(underorden Dicranineae) der lamina bare er noen få cellerekker i kanten
ved basis av bladet, og hos bjørnemosene (orden Polytrichales) der
nerven har flere høge langsgående lameller med klorofyllceller på oversida
(nyttig både for assimilasjon og vannhusholdning). Bladene har ofte ei tydelig
kantlist av fortjukkete celler (støttefunksjon). De fleste moser har blad
(lamina) som bare er ett cellelag tjukk, men hele eller deler av bladet kan
også være to eller flere cellelag tjukk. Dette gjelder nok særlig moser som
vokser i tørrere habitater. I toppen av bladet løper ofte bladnerven ut i en
hårspiss, særlig tydelig hos noen bjørnemoser og i underordenene Pottiineae
(f.eks. i slekta tustmose Tortula) og Grimmiineae (f.eks. i
slekta gråmose Racomitrium). Et annet spesielt trekk i flere store
grupper er spesielle celler nede ved bladgrunnen, såkalte bladøreceller (alarceller)
som danner bladører (aurikler). Disse kan enten være mindre og tydelig
mer tjukkveggete enn andre celler, eller mye større og mer tynnveggete. De er
særlig typiske hos sigdmoser (underorden Dicranineae) og i mange viktige
slekter i underorden Hypnineae (f.eks. hos flettemose og klomoser).
Formen
på bladcellene er også ofte karakteristisk for større grupper (underordener).
Noen store grupper har mer eller mindre kvadratiske eller avrundete celler
(f.eks. Pottiineae og Orthotrichineae), eller cellene kan være rektangulære
og omlag tverre i endene (f.eks. Dicranineae). Andre grupper har meget
lange og smale celler som er spisse i endene (f.eks. i den meget store ordenen Hypnineae).
Tynnveggete celler er typisk for moser som vokser fuktig eller vått,
tjukkveggete for de som vokser tørt eller periodevis tørt (f.eks. Orthotrichineae
på trestammer og bergvegger). Noen bladmosegrupper har karakteristiske porer
mellom cellene, særlig typisk i Dicranineae; andre har bølgete
cellevegger, særlig typisk i gråmose Racomitrium (Grimmiineae).
To andre begreper som brukes i nøkler og beskrivelse er om cellene har papiller
(en eller flere vorter på celleveggen, særlig tydelig i klokkemoser Encalyptineae
og i begermoser Pottiineae) eller mamiller (at hele celleveggen buler
ut). Papiller og mamiller antas å ha betydning ved at de reduserer bladenes
overflatespenning og letter vannopptaket og gassutskiftningen mellom blad og
luft.
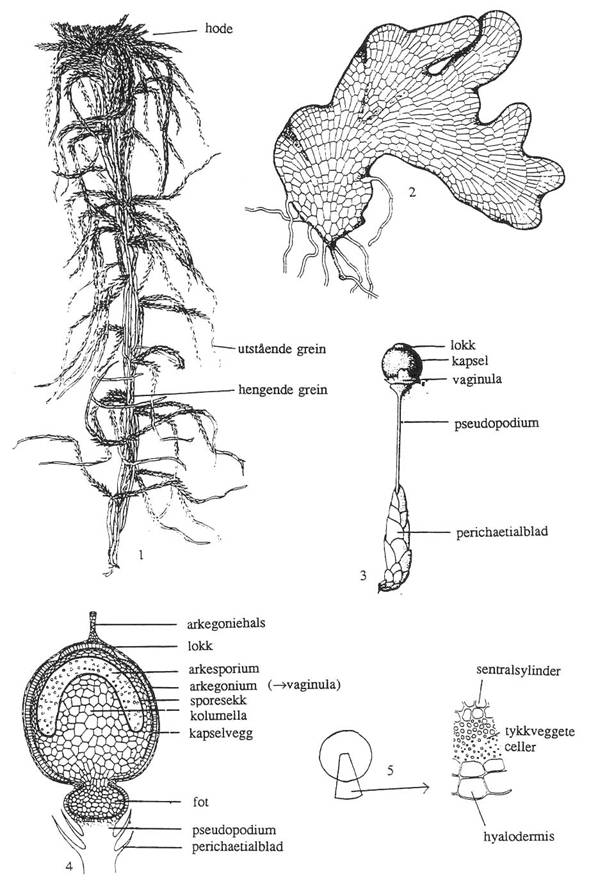
Sporofyttens bygning.
Bladene rundt anteridiene og arkegoniene er oftest større enn vanlige blad. Sammen med kjønnsorganene betegnes de ofte ’inflorescens’, som
betyr blomsterstand og derfor bør forbeholdes karplanter med ekte blomster (’flor).
Et bedre uttrykk er derfor perichaetium. En tid etter befruktningen
brister arkegonieveggen. Den nedre delen av veggen blir til en ring – vaginula
– rundt foten av sporofytten; den øvre delen blir sittende som ei beskyttende
hette – kalyptra – over kapselen til den er moden.
Sjølve
sporofytten har grunnleggende samme plan hos alle Bryidae og består av
fire hoveddeler: seta (stilk), apofyse (hals), theca
(sporeproduserende del), og operculum (lokk).
Apofysen
er den nedre, ikke spore-produserende delen av kapselen. Den kan være lite
markert, noe avsnørt fra theca, asymmetrisk med en utbulning på ene sida
(struma, hos f.eks. halsbyllskortemose Cynodontium strumiferum), eller
sterk oppsvulmet. Det siste finnes i møkkmoser (underordenen Splachnineae)
og særlig i slekta møkkmose Splachnum der den er stor og kule- eller
parasollforma, ofte sterkt farga, og lukter (for oss) ubehagelig. Disse mosene
vokser på dyrekadaver og dyremøkk; de er nekrofile og/eller koprofile. Her
fungerer apofysen som attraksjon for insekter. Insekter som lander på apofysen
får de klebrige sporene på beina og sprer deretter sporene videre til ferske
kadaver og møkkruser. Apofysen er ellers den delen av sporofytten der en oftest
finner spalteåpninger, enten overflatiske eller innsenkete.
Den
sporeproduserende delen av sporofytten – theka – avgrenses øverst av en annulus
(ring) som ved kapselmodningen forslimer (løser seg opp). Da løsner operculum
(lokket), og faller raskt av (delvis presses lokket
vekk av et organ som omtales nærmere nedafor – peristomet). Dette er den
viktigste delen av åpningsmekanismen i en mosekapsel. Hos noen moser mangler
peristomet (fenomenet kalles gymnostomi), eller kapselen mangler enhver
åpningsmekanisme (kleistokarpi). Redusert åpningsmekanisme antas å være
avledet fra forfedre med peristom og intakt åpningsmekanisme.
Litt mer om peristomet
Et
særlig viktig – og spesifikt – trekk for Bryidae er forekomsten av en
spesialisert tannstruktur på toppen av sporofytten: peristomet. Peristomet
har som funksjon å regulere og lette spredning av sporer fra kapselen. I fuktig
vær lukker tennene åpningen, og de ofte tannete og ujamne tennene kan også bøye
seg ned i kapselrommet slik at sporene henger fast i dem. I tørt vær retter de
seg ut og spriker, og sporer som henger på eksponeres for spredning med vind
(og dyr). Peristomet utvikles fra flere og til dels ulike cellelag i
sporofytten, og på ulikt vis, og utformingen av det er ofte spesifikt for
ordener og underordener. Sagt på annet vis: peristomet antas
å være homologt i (nesten?) alle nålevende Bryidae og synes å ha en låg
evolusjonsrate (’treghet’, ’konservatisme’) som gjør det egnet som
karaktersett for å skille mellom taksa, på nivå fra ordener ned til slekter og
til dels arter. Tabell 8 gir en oversikt over antatt oprinnelige og avledete
karaktertilstander for peristomet.
Tabell 8.
Antatt opprinnelige og avledete karaktertilstander for peristomet i underklasse
Bryidae.
Karakter Opprinnelig
tilstand Avledet
tilstand
parastom
(nematodont del) til stede mangler
ornamentering kornet-papilløs stripet,
glatt etc.
endostom kontinuerlig
membran adskilte
tenner
fortykking av tenner svak; lik fortykking fra begge peri- sterk; ulik fortykking fra begge
peri-
stomdannende
lag stomdannende
lag
relativ plassering av tenner i rett innenfor hverandre alternerende
dobbelt peristom
Tverrsnitt
gjennom en ung Bryidae-sporofytt er vist i Figur 17. Det tidlige
anlegget til sporofytt har to cellelag. Det indre laget endotheciet
(endo = inni) utvikler seg til den indre sterile søylen kolumella, den
indre sporesekkveggen, og det sporedannende laget arkesporiet. Det ytre
laget amfitheciet (amfi = omkring, jf. amfiteater) utvikler seg til den
ytre sporesekkveggen og til assimilasjonsvev adskilt av luftrom, parenkym
utafor luftrommene, og ytterst en epidermis. Øverst har den umodne kapselen et
lokk (som igjen kan være dekt av ei hette, calyptra, dannet av en rest av arkegoniet).
Peristomet
er en fortsettelse av flere av disse lagene i amfitheciet over sporesekken. Den
ytre sporesekkveggen fortsetter som et indre peristomdannende cellelag (IPL).
Det cellelaget som avgrenser luftrommene utover fortsetter som et primært
peristomdannende cellelag (PPL). Cellelag i parenkymet fortsetter
som de ytre peristomdannende cellelag (YPL). Peristomet oppstår
ved forskjellige omdannelser av disse lagene og skjer på tre hovedmåter:
A.
Nematodont peristom (Figur 18) av Tetraphis-typen (i ordenen Tetraphidales,
firtannmosene). Her dannes ikke peristom direkte av lagene nevnt ovafor, men en
gruppe av celler under lokket fortykkes til en kjegle som deler seg i fire
kompakte fliker eller tenner. I motsetning til de andre gruppene (se nedafor),
så forslimes ingen celler. Tennene er derfor glatte, uten ornamentering av
rester fra forslimete celler. Denne typen periostom er trolig ikke homolog med
noen av de andre typene. Man tror nå at peristomet hos Tetraphis er utviklet sekundært ved fortykkelse av cellene under
lokket, fra gymnostome forfedre (det vil si forfedre som hadde mistet
peristomet). Til forskjell fra de andre typene, så er ikke tennene hos Tetraphis bevegelige.
B.
Nematodont peristom (Figur 18) av Polytrichum-typen (i ordenen Polytrichales,
bjørnemosene). Her forsterkes en serie av bunter av celler i en ring rundt
toppen av sporofytten (celler fra IPL og PPL) mens celler mellom disse buntene
og både innafor og utafor dem forslimes og settes av som vorter på tennene som
dannes fra hver bunt. Peristomet hos bjørnemosene er homologt med det
arthrodonte peristomet, men morfologisk svært ulikt dette. Bjørnemosene er alene
om å ha en hinne (epifragma) som er spent ut mellom spissen av
peristomtennene og som holder den breie kapselmunnen lukket. Epifragma sikrer
at sporene ikke blir våte og at de lettest blir spredt i tørt vær.
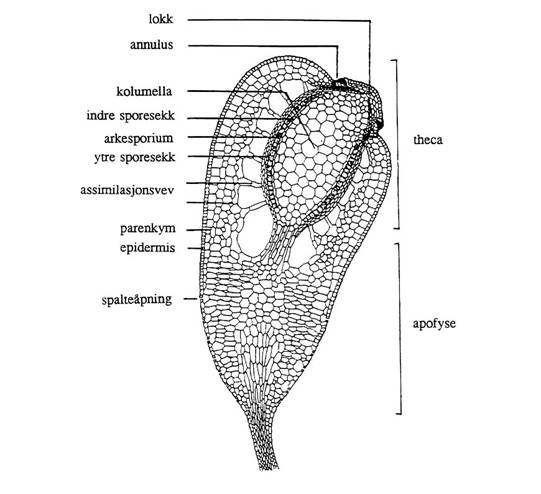
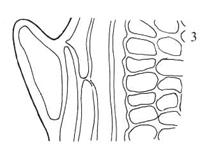
Figur 17. Underklasse
Bryidae: Lengdesnitt gjennom ung kapsel. Etter Andersen et al. (1976).
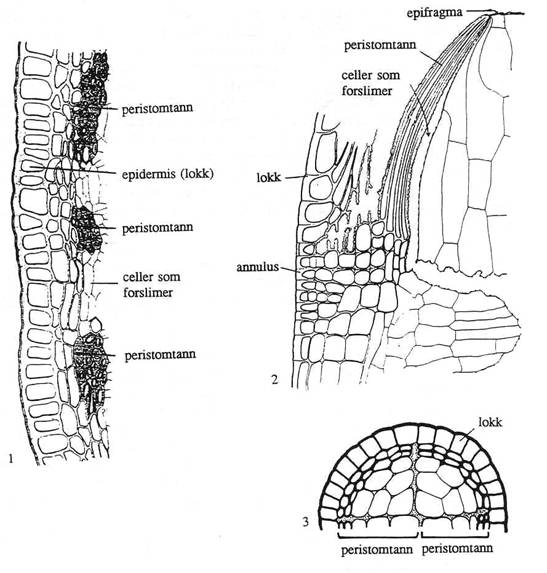
Figur 18. Underklasse Bryidae (forige side):
Nematodonte peristomtyper. 1-2. Polytrichum-type. 1: Polytrichum
formosum, tverrsnitt gjennom ung kapsel i peristomregionen; viser tre
peristomtenner hver bestående av flere hele celler med fortykket vegg. 2: Atrichum
undulatum, lengdesnitt gjennom ung kapsel i peristomregionen. 3: Tetraphis-type,
Tetraphis pellucida. Tverrsnitt gjennom nesten moden kapsel nær basis.
Lokket er ett cellelag tykt. Etter Ruhland (1924) og Edwards (1984).
C.
Arthrodont peristom (figur 19) forekommer i mange ulike former i orden Bryales, og kan grupperes i minst åtte
ulike typer. Peristomtype er en av de viktigste egenskapene for å skille underordener
innen Bryales.
Felles
for arthrodonte peristomer er at celleinnholdet i cellene i de peristomdannende
lagene normalt forslimer mens deler av celleveggene består. Peristomtennene er
de vertikale, sterkt fortykkete celleveggene som skiller de peristomdannende lagene.
Slim fra cellene størkner i karakteristiske tverr-ribber og andre ornamenter,
særlig i mønster eller loddrette og vannrette cellevegger slik at tennene ser
leddete ut (arthro = ledd, jfr arthritis = leddgikt). Ofte forekommer tennene i
2–3 ringer, en indre ring endostomtenner (endostomet) dannet fra
veggen mellom IPL og PPL og en ytre ring eksostomtenner (eksostomet)
dannet fra veggen mellom PPL og innerste lag av YPL. Stundom forekommer også
tenner fra veggene mellom ulike lag i YPL, kalt prostomtenner (prostomet).
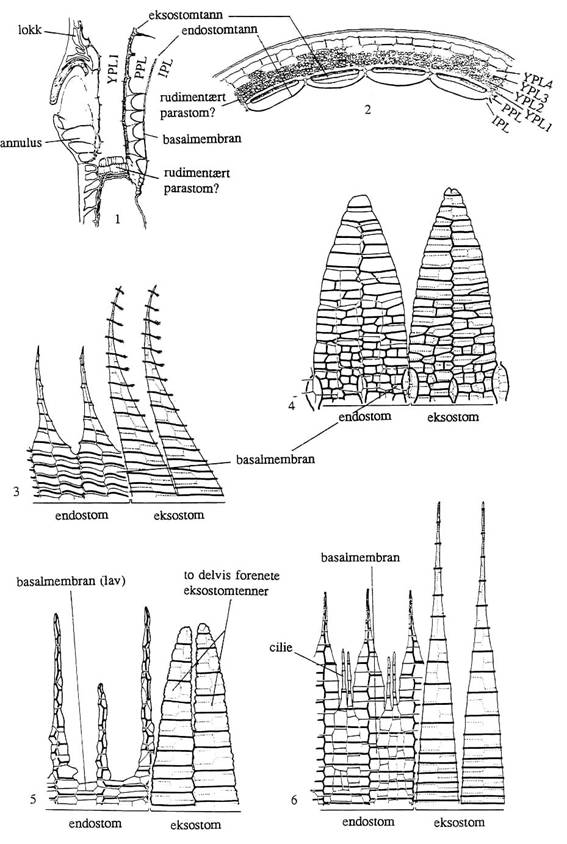
Figur
19. Orden Bryales: Arthrodonte peristomtyper. 1-3. Funaria-type; Funaria
hygrometrica. 1: Lengdesnitt gjennom ung kapsel i peristomregionen, merk
rudimentært parastom (?) dannet fra YPL2 og YPL3. 2: Tverrsnitt gjennom kapsel
nær basis av peristomet. 3: Peristomtenner sett fra kapselens innside. 4: Splachnum-type;
Splachnum ampullaceum, peristomtenner sett fra kapselens innside. 5: Orthotrichum-type;
Orthotrichum rivulare, peristomtenner sett fra kapselens innside. 6. Bryum-type;
peristomtenner sett fra kapselens innside.
De
ulike typene av arthrodont peristom skilles bl.a. på hvor mange av disse
tannkransene som er utviklet, hvor mange tenner der er i hver krans, og
forholdet mellom tanntallene i ulike kranser. Vi går ikke inn på dette her
bortsett fra å nevne at det går et visst skille mellom underordener med
regelmessig to kranser peristomtenner (diplolepid) og de med bare en
krans (haplolepid, tilsvarende den indre kransen - endostomet - hos de
diplolepide). Diplolepid peristom karakteriserer underordenene Bryineae,
Hypnineae, Leucodontineae, Hookeriineae, og i spesialtyper
i hver av underordenene Encalyptineae, Funariineae, Splachnineae
og Orthotrichineae. Haplolepid peristom karakteriserer underordenene Pottiineae,
Dicranineae, Fissidentineae, Seligeriineae og Grimmiineae.
Underordenene Schistostegineae og Archidiineae er konstant uten
peristom; hos den siste ordenen spres sporene ved at kapselen bare
disintegrerer. Også i de andre underordenene kan peristom mangle hos enkelte
slekter eller arter.
Vegetativ formering
De
fleste dioike moser, dvs. moser som har med særskilte hann- og hunngametofytter,
produserer sjelden sporofytter og dermed også spore. Også hos monoike moser,
med anteridier og arkegonier på ulike greiner på samme gametofytt, kan det være
få sporofytter å finne. Vegetativ formering av gametofytten er derfor utbredt,
og hos mange moser den dominerende formeringsmåten. Slik vegetativ formering
skjer på to eller fire hovedmåter:
Fragmentering
ved at deler av mosen løsner, f.eks. ved tråkk eller sterk vind. Som nevnt
ovafor gror det da oftest ut et protonema fra fragmentet før gjendannelse av normale
gametofytter. Fragmentering er trolig en hovedformeringsmåte i arktiske, alpine
og tørre habitater.
Dannelse
av spesielle vegetative formeringsorganer, gemmae. Her er det tre
hovedtyper etter hvilken del av gametofytten som er involvert: stengeldannelser
(a), bladdannelser (b), og rhizoid‑ og protonemadannelser (c):
(a)
Stengeldannelser er hele små skudd eller deler av skudd (f.eks. bulbiller)
som løsner. Hos f.eks. sigdmose Dicranum spretter skuddspisser med blad
av ved berøring (’hoppende lopper’). Hos en del arter innen den store
nikkemose-slekta Pohlia dannes små dvergskudd med bladanlegg i
bladhjørnene som faller av og spres enten ved berøring eller ofte med vann (figur
20). Disse spredningsorganene representerer komplette
’miniplanter’ som fort vokser opp til nye individer.
(b)
I slekta filtmose Aulacomnium dannes små reduserte, tjukke blad som
grolegemer i skuddspissen. I andre slekter er bladene eller hos noen bladspissene (f.eks. skjørvrimose Tortella fragilis)
skjøre og brekkes lett av ved berøring.
(c)
Gemmae fra rhizoider og protonema er mer utbredte, men mindre distinkte typer.
Rhizoid-gemmae er knoller i enden av lange, stive rhizoider, nå kjent hos en
rekke arter (f.eks. i den store og kompliserte slekta vrangmose Bryum).
Protonema-liknende, tråd‑ eller kuleformete gemmae på blader og i
bladhjørner på stengler er vanlig.
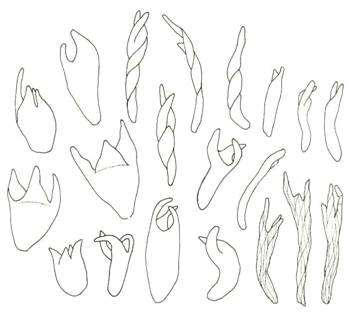
Figur 20. Ulike typer av
yngleknopper (gemmae) hos nikkemosen Pohlia proligera. Yngleknoppene er
dvergskudd med bladanlegg. Fra Smith (1980).
Systematisk inndeling av Bryidae
Det finnes en
rekke forslag til inndeling av Bryidae. Disse varierer blant annet med hensyn
til hvilken rang de gir de enkelte undergruppene, men de fleste inndelingene holder
på én stor undergruppe (orden Bryales med en rekke underordener)
og to satelitt-undergrupper: bjørnemoser (orden Polytrichales) og
firtannmoser (orden Tetraphidales). Separat status for bjørnemosene
begrunnes bl.a. i det spesielle peristomet, bladoppbyggingen, og den spesielle
stengelanatomien. Separat status for firtannmoser bygger særlig på peristomet (men
se over). Skomoser har en litt usikker status, og har blitt sett på som en egen
orden (Buxbaumiales)
eller som en underorden Buxbaumiineae av Bryales (vi har valgt denne løsningen i dette
kompendiumet). Nyere behandlinger plasserer skomoser sammen med orden Tetraphidales! Noen av de spesielle trekkene ved skomoser, bl.a. det kombinerte
peristomet (se nedenfor) i tillegg til at gametofytten er redusert og at
sporofytten er den dominerende generasjonen (kan være sekundære reduksjoner) er
årsaken til usikkerheten knytten til skomosenes plassering i systemet.
Nedafor er gitt
noen morfologiske stikkord for hver av ordenene og underordenene, mer som en
hjelp ved plassering av de mosene man vil møte på laboratorie‑ og
feltkurs enn som kunnskapsstoff (pensum). Alle figurer er lånt fra Smith (1980).
A.
Orden Polytrichales – bjørnemoser
Akrokarpe moser (repetisjon: ugreinete,
opprette, med toppstilte kjønnsorganer). Blad med langsgående lameller av
klorofyllceller på den breie nerven. Stengel med både leptoider (levende
ledningsceller) og hydroider (døde ledningsceller); ledningsvev godt utvikla i
både stengel og blad og med forbindelse stengel-blad (ekte bladspor). Kapsel på
lang seta. Peristom av 32 eller 64 tenner dannet av hele celler (nematodont),
med ei hinne (epifragma) som ei trampoline mellom
peristomtannspissene. Viktige slekter i skog, hei, fjell og tørr myr: Polytrichum
bjørnemose, Pogonatum krukkemose, Atrichum taggmose.
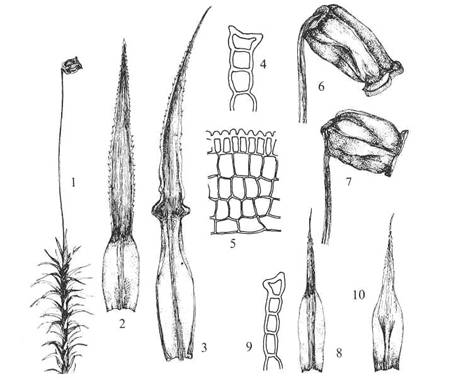
Figur
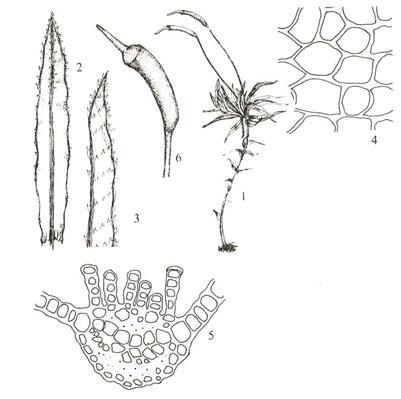
21. Orden Polytrichales bjørnemoser. Polytrichum commune
storbjørnemose. Habitus med gametofytt og sporofytt (1); blad med slire med
smal nerve og plate der nerven er omtrent hele bredden (2); blad rundt
antheridiesamling (3); lamell på blad nerven i tverrsnitt (4); lamell sett på
langs (5); kapsel (6-7). (8-10, som 4, 2 og 3 hos en varietet).

B. Orden Tetraphidales –
firtannmoser
Akrokarpe moser. Bladnerve uten
lameller. Stengel med bare hydroider. Kapsel på lang seta, uten annulus
(åpningsring). Peristom (nematodont) av fire kompakte, ubevegelige tenner,
neppe homologt med peristomet hos andre bladmoser. Protonema med avflatete
bladliknende fliker (’protonemale blad’). Mest på råtten ved i skog (iblant på
naken torv): Tetraphis firtannmose.
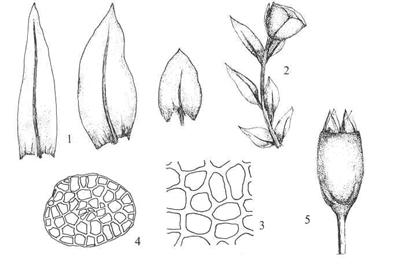

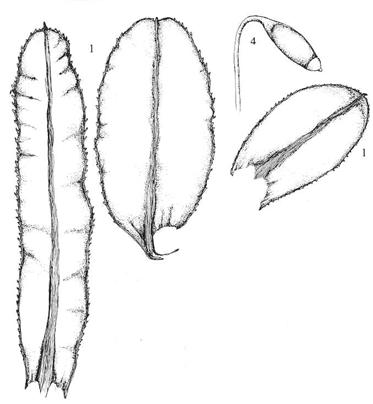
Figur 23. Orden Tetraphidales
firtannmoser. Tetraphis pellucida firtannmose. Blad (1); skudd med
yngleknoppskål (2) og yngleknopp (gemmae 4); korte bladceller (3); kapsel med
firefliket nematodont peristom (5). ‑‑ Tetrodontium brownianum.
Protonema med avflatete thalloide fliker (til høyre).
C. Orden Bryales – ekte bladmoser
Akrokarpe og pleurokarpe moser
(repetisjon: pleurokarp, med greinete, ofte liggende skudd og tilsynelatende
sidestilte kjønnsorganer). Stengel med bare hydroider eller uten ledningsvev.
Peristom arthrodont eller en kombinasjonstype (hos skomosene). Deles i 16
underordener. Tabell 9 gir oversikt over opprinnelige og avledete
karaktertilstander.
Tabell 9.
Antatt opprinnelige og avledete karaktertilstander i orden Bryales.
Karakter Opprinnelig
tilstand Avledet
tilstand
Gametofytt
kromosomtall
(n) lavt høyt
(polyploidisering)
plassering
av gametangier akrokarp
(endestilt) pleurokarp
(sidestilt)
forgreining enkel kompleks
sentralsylinder velutviklet redusert
bladnerve til stede redusert
bladceller,
form tynnveggete,
rektangulære tynnveggete,
langstrakte og
tykkveggete,
kvadratiske
bladceller,
papiller mangler finnes
blad, alarceller mangler differensiert
seta lang kort
kapselstilling opprett horisontal
eller hengende
kapseloverflate glatt furet
kapsel,
stomata overflatiske innsenket
annulus finnes
mangler
C1. Underorden Buxbaumiineae
– skomoser
Akrokarpe moser
med svært liten gametofytt, ofte med sterkt reduserte blad eller uten blad.
Sporofytt med effektiv fotosyntese. Peristom av kombinert type, ytre tenner av
hele celler (nematodont), indre tenner av cellevegger (arthrodont). Viktig (men
nokså sjelden) slekt på råtten ved og åpen, humusrik jord: Buxbaumia
skomose.
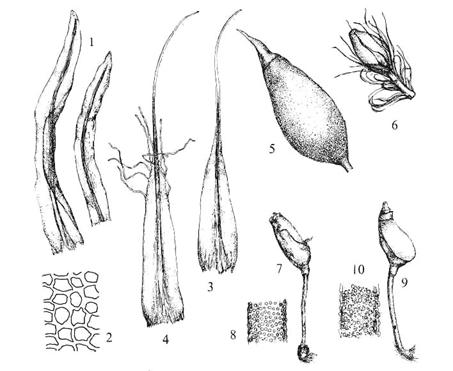
Figur
24. Underorden Buxbaumiineae skomoser. Diphyscium foliosum nøttemose.
Blad (1) og blad rundt antheridiesamling (3-4); korte bladceller (2); stengel
med kapsel (6); kapsel med lokk (5). ‑‑ Buxbaumia skomose.
Habitus (7, 9) og setaoverflate (8, 10).
C2. Underorden Encalyptineae
– klokkemoser
Akrokarpe moser. Blad oftest
tungeformete, med kraftig nerve og ofte med hårspiss. Bladceller kvadratiske,
sekskantete eller nederst rektangulære, svært papilløse. Seta lang og kapsel
sylindrisk, med en svært stor og tydelig hette ("klokke"). Peristom
arthrodont, men svært variabelt (diplolepid, haplolepid, rudimentært eller
mangler). Viktig slekt: Encalypta klokkemose (på tørr, oftest åpen og
ofte baserik jord).

C3. Underorden Funariineae
– bråtemoser
Akrokarpe. Blad
eggforma til lansettforma, med tydelig nerve. Bladceller store, tynnvegga,
rombeforma til sekskanta. Seta variabel, i visse slekter svært kort, i andre
lang. Kapsel kuleforma til pæreforma, oftest med tydelig apofyse, ofte også
skjev. Peristom variabelt, arthrodont, oftest diplolepid, man kan også være
haplolepid eller mangle. Vokser ofte på tørr, åpen jord. Viktig slekt: Funaria
bråtemose.
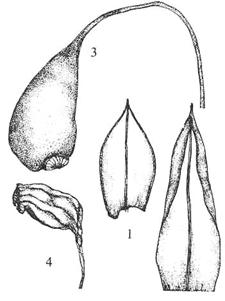
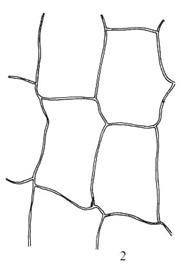
Figur
26. Underorden Funariineae bråtemoser. Funaria hygrometrica
bråtemose. Blad (1); svært store og tynnveggete bladceller (2); skjev kapsel
med lukket peristom, på hygroskopisk skaft (3); skrumpen kapsel (4).
C4. Underorden Splachnineae
– møkkmoser
Akrokarpe.
Likner Funariineae, men seta lang og kapsel oftest med sterkt utvidet
apofyse som en kule eller farget parasoll. Insekter tiltrekkes av lukt og/eller
farge og sprer mosene. Peristom arthrodont, haplolepid, men spesialisert.
Vokser på døde dyr eller møkk. Viktige slekter: Splachnum parasollmose
og Tetraplodon lemenmose.
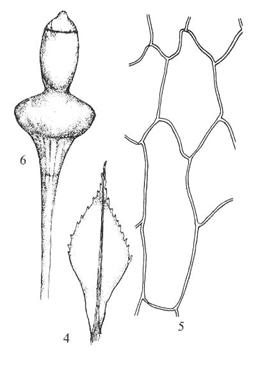
Figur
27. Underorden Splachnineae møkkmoser. Splachnum ampullaceum
pæremøkkmose. Tannete blad (4) med store, tynnveggete bladceller (5). Kapsel
med sterkt oppsvulmet apofyse som skiller ut et luktstoff som tiltrekker
møkkinsekter (6).
C5. Underorden Orthotrichineae
– bustehettemoser
I prinsippet
akrokarpe, men virker ofte pleurokarpe fordi sidegreiner forekommer hyppig.
Blad eggforma til lansettforma, med tydelig nerve. Bladceller nederst
rektangulære, øverst korte, ofte svært tjukkveggete og papilløse. Seta oftest
relativt kort. Kapsel oftest eggforma. Peristom arthrodont, varierer fra
diplolepid med en kraftig ytre ring og en indre ring av svært tynne tenner, til
enringet (indre ring mangler), eller uten peristom (gymnostomt). Viktige moser
som oftest vokser i små tuver eller tuster på bergvegger og trestammer. Viktige
slekter: Amphidium polstermose, Hedwigia steinmose, Orthotrichum
bustehette, og Ulota gullhette.

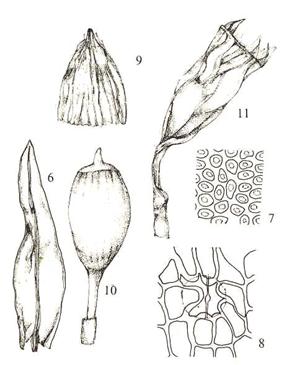

C6. Underorden Bryineae
– vrangmoser
Akrokarpe. Blad
linjeforma til breie, med isodiametriske til linjeforma celler (stor
variasjon), ofte mamilløse (med utbuktning av celleveggen), men sjelden
papilløse. Seta lang. Kapsel nikker eller henger. Peristom arthrodont, diplolepid,
fullstendig og velutviklet i de fleste grupper. Mange slekter og arter har
velutviklete gemmae. Meget stor gruppe, som forekommer i en rekke ulike
habitater. Noen av de viktigere slektene: Aulacomnium filtmose, Bartramia
kulemose, Bryum vrangmose, Leptobryum pæremose, Mnium
tornemose, Paludella piperensermose, Philonotis kjeldemose, Plagiomnium
fagermose, Pohlia nikkemose, Rhizomnium rundmose, og Rhodobryum
rosettmose.

Figur
30. Underorden Bryineae vrangmoser. Plagiomnium undulatum krusfagermose.
Blad med forsterket kant of tenner (1); korte bladceller, men forlengete og
forsterkete celler i kanten (3); nikkende kapsel med apofyse og lokk (4)

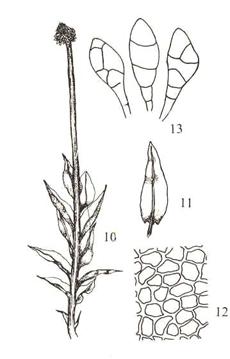
C7.
Underorden Hypnineae – flettemoser
Pleurokarpe.
Hovedgruppen (Hypnineae s. str.) har blad som varierer
fra lineære til sirkelrunde. Nerve mangler, er kort og dobbel eller lang.
Bladører finnes ofte, og kan være velutviklete. Bladceller i hovedgruppen smalt
rombeforma til lineære (ofte svært lange), oftest uten papiller eller mamiller.
Seta lang. Kapsel oftest horisontalt eller skråstilt på seta. Peristom
arthrodont, diplolepid. Stor gruppe som inneholder mange av de dominerende
mosene i skog, hei, på myr (unntatt torvmosemyr) og i ferskvatn. Noen få av de
viktigste slektene er: Amblystegium krypmose, Brachythecium
lundmose, Calliergonella broddmose, Calliergon tjønnmose, Campylium
stjernemose, Cratoneuron kalkmose, Eurhynchium moldmose, Hygrohypnum
bekkemose, Hylocomium etasjemose, Hypnum flettemose, Plagiothecium
jamnemose, Pleurozium furumose, Ptilium fjørmose, Rhytidiadelphus
kransemose, Rhytidium labbmose, Sanionia bleikmose, Scorpidium
makkmose, og Warnstorfia nøkkemose. En undergruppe som av og til
oppfattes som en egen underorden (Thuidiineae tujamoser) skiller seg ved
regelmessig forgrening, kortere bladceller som ofte er runde, tjukkveggete og
sterkt papilløse. Viktige slekter: Anomodon raggmose, Helodium
myrfjør, Myurella trinnmose, og Thuidium tujamose.


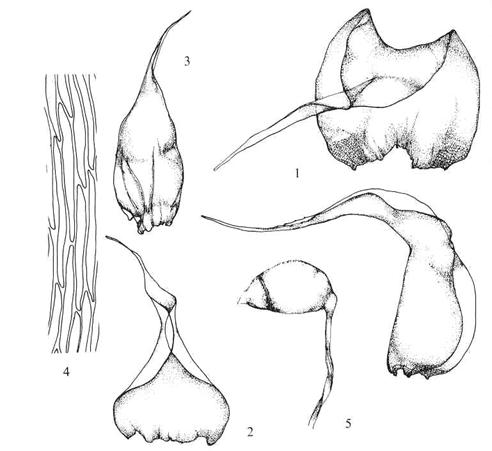
Figur
34. Underorden Hypniineae flettemoser. Rhytidiadelphus squarrosus
engkransemose. Blad uten nerve, med utdratt, tilbakebøyd spiss (1-3) og store
bladhjørner (1); midtre bladcedller lange og smale med spisse ender (4); kapsel
på tvers på seta, med tydelig apofyse (5).
C8. Underorden Leucodontineae – ekornmoser
Pleurokarpe. Hovedstengel
ofte krypende, men med oppstigende eller opprette sideskudd. Forgrening fjør-
eller treliknende eller uregelmessig. Blad i tre eller flere rekker eller
folda, eggforma til lansettforma, spisse og med enkel, dobbel eller ofte
manglende nerve. Bladceller kvadratiske til linjeforma, i noen slekter
papilløse. Seta kort eller lang; kapsel rett eller skrå. Peristom arthrodont,
diplolepid. Heterogen gruppe, trolig ’samlesekk’ for
moser med forskjellig evolusjonært opphav.Viktige slekter: Climacium palmemose
(med dendroid forgrening), Fontinalis elvemose (vassmoser med blad i tre
tydelige rekker), Leucodon ekornmose (med nervelause blad som er sterkt
foldet på langs), og Neckera fellmose (med skjeve blad og avflatete
skudd).

C9. Underorden Hookeriineae
– dronningmose
Pleurokarp.
Skudd flate med blad til to sider. Blad store, ofte asymmetriske, med kort,
enkel eller dobbel nerve eller (som hos den ene arten som finnes i Norge) uten
nerve. Bladceller svært store, tynnveggete. Lang seta og horisontal kapsel.
Peristom arthrodont, diplolepid. En flott norsk art på fuktig berg og jord i
skygge: Hookeria lucens dronningmose.

C10.
Underorden Pottiineae – begermoser
Hovedsakelig
akrokarpe. Blad linjeforma, spatelforma eller eggforma, med kraftig nerve, i visse
slekter med lang hårspiss. Bladceller øverst kvadratiske eller sekskantete,
nederst rektangulære, ofte papilløse. Seta lang eller kort. Kapsel rett eller
noe bøyd. Peristom arthrodont, haplolepid, peristomtenner ofte delt i
sylformete fliker og spiralvridd, men kan mangle. Mest små moser på mer eller
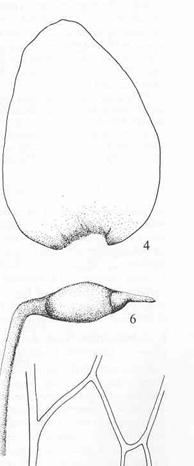
mindre åpen jord. En rekke viktige slekter, f.eks.: Barbula skruemose, Pottia
begermose, Tortella vrimose og Tortula tustmose.

C11.
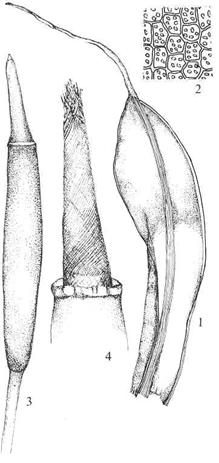
Underorden Dicranineae – sigdmoser
Akrokarpe. Blad
smale, spisse, ofte bøyd til en side på skuddet (som hos sigdmosene), oftest
med tydelig nerve, ofte med bladører. Bladceller kvadratiske til rektangulære.
Kapsel oftest på lang seta og ofte bøyd. Peristom arthrodont, haplolepid, peristomtenner
ofte todelte. Flere familier og en lang rekke viktige slekter i de fleste
habitater, f.eks.: Ceratodon veimose, Dicranella grøftemose, Dicranum
sigdmose, Ditrichum bustmose, Kiaeria frostmose
(snøleie-spesialist) og Leucobryum blåmose.
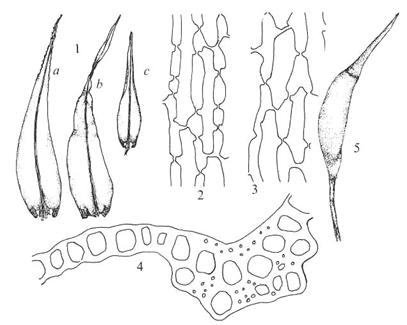
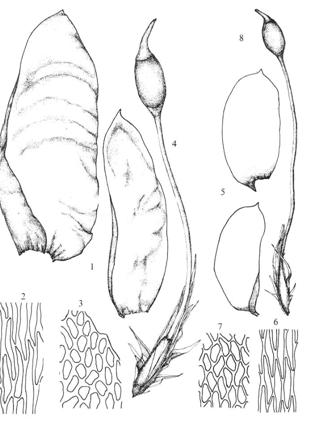
Figur
38. Underorden Dicranineae sigdmoser. Dicranum scoparium
ribbemose. Blad (1); bladceller med porer i celleveggene (2-3); bladnerve med
ledningselementer, legg merke til ett cellelag i plata, men fler ei nerven (4);
kapsel med apofyse og lokk (5). ‑‑ Ceratodon purpureus
ugrasvegmose. Blad (9); kapsel med apofyse og lokk (10); dobbel peristomtann
(11).
C12.
Underorden Fissidentineae – lommemoser eller sagmoser
Akrokarpe. Blad
i prinsippet skruestilte, men står i to rekker. Unik bladbygning. Bladene
består av tre deler, en foldet del (lomma) som er den egentlige bladplata
(lamina) og to sammenvokste vinger som er tolket som utvekster fra bladnerven.
Bladceller korte og oftest sekskantete (heksagonale). Kapsel på lang seta.
Peristom arthrodont, haplolepid. Viktig slekt: Fissidens lommemose
(oftest på fuktig berg og jord, noen arter vokser i vann).
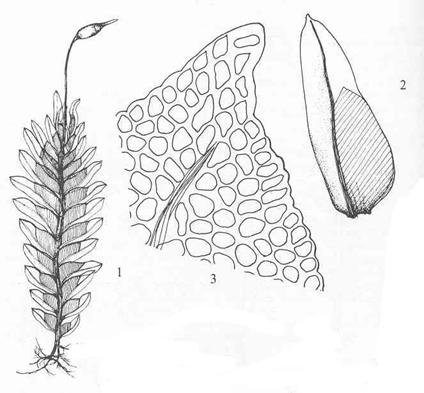
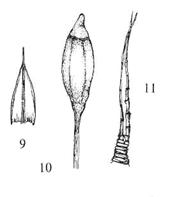
Figur
39. Underorden Fissidentineae lommemoser. Fissidens osmundoides
stivlommemose. Gametofytt med sporofytt (1); blad der den skraverte delen er
den egentlige plata og de kvite delene to vinger vokst ut fra bladnerven (2);
bladspiss med nerve som stopper før spissen og avrundete, tjukkveggete celler
(3).
C13. Underorden Seligeriinae
– blygmoser
Akrokarpe. Bittesmå
moser (få mm store) som i bygning likner Dicranineae, men bladene
mangler bladører. Kapsel kort, uten annulus, peristom arthrodont og haplolepid,
men med hele tenner. Små moser på berg og fuktig baserik jord. Viktigste slekt
i Norge: Seligeria.

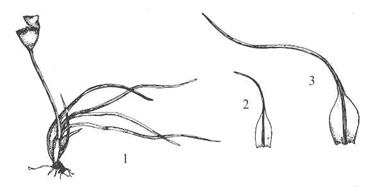
C14. Underorden Grimmiineae
– gråmoser
Akrokarpe og
kladokarpe moser (kladokarp bryukes som betegnelse på mellomtingen mellom
akrokarp og pleurokarp forgreiningsmåte; greinet med relativt korte sidegreiner,
arkegonier endestilte eller på sidegreiner), oftest matte‑ eller
tuveplanter. Blad linjeforma eller eggforma, med tydelig nerve, svært ofte med
hårspiss (som ofte er komplisert tannet). Bladceller kvadratiske til
rektangulære, tjukkveggete og ofte med bølgete vegger, ofte papilløse. Blad ofte flere cellelag tjukke.
Seta lang eller kort. Kapsel rund til sylindrisk. Peristom arthrodont,
haplolepid. Viktige moser i hei og særlig på berg. Viktige slekter: Grimmia
knausmose, Racomitrium gråmose, Schistidium blomstermose.


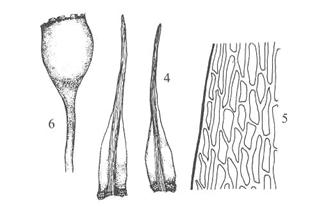
Figur
41. Underorden Grimmiineae gråmoser. Racomitrium canescens
sandgråmose. Skuddsystemer (1, 8); bladtyper (2) og tannete hårspiss (3); blad
med bølgete cellevegger (4, 6) og med høge papiller (5); kapsel (7).
C15. Underorden Archidiineae
– sporemoser
Hovedsakelig
akrokarp, men greiner seg fra rett under perichaetiet (samlingen av
kjønnsorganer og støtteblad). Seta redusert og kapselvegg bare ett
gjennomskinnelig cellelag tjukk. Peristom mangler, de store sporene spres når
kapselveggen råtner opp. Usikker systematisk plassering, men gametofyttens
bygning knytter an til Dicraniineae og
Seligeriineae. Bare ei slekt: Archidium
sporemose (ørliten mose på åpen, fuktig jord).
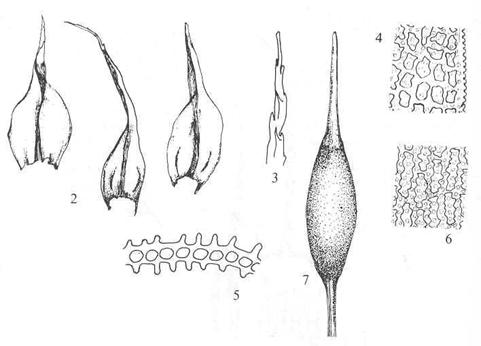
Figur 42. Underorden Archidiineae
sporemoser. Archidium alternifolium sporemose. Skudd med antheridiesamling (1);
blad (2-3); avlange bladceller (4).
C16. Underorden Schistostegineae – lysmoser
Akrokarp. Varig,
thallusforma protonema der cellene er lys-reflekterende. Blad i to rekker og
lengdestilte på skuddene, uten nerve, med tynne, avlangt rombeforma celler.
Lang seta og eggforma kapsel uten peristom. Usikker systematisk plassering, men
molekylære data og gametofyttens bygning kan indikere slektskap med Bryineae. Bare én art, Schistostega
pennata lysmose, en spesialist i bergsprekker og huler med lite lys.
Figur 43. Underorden Schistostegineae
lysmoser. Schistostega pennata lysmose. Gametofytter, en med sporofytt (1); blad innsatt på
langs på stengelen (2); avlange, tynnveggete bladceller (3).
MOSENES ØKOLOGI
DE FYSIOLOGISKE FORUTSETNINGENE FOR MOSERS VEKST
Mosene har i mindre
grad enn andre landplantegrupper klart å gjøre seg uavhengig av vann. Dette
gjelder både for den kjønnete formeringen og for gametofyttens vekst. Når moser
som gruppe likevel har overlevd fram til i dag og lyktes i å innta en rekke
økosystemer, det store mangfoldet av andre landplanter til tross, skyldes det
at mosene har nådd lengre i utviklingen av tørketoleranse (evne til å overleve
tørke), til dels også uttørringsresistens (evne til å forhindre uttørring), enn
andre landplantegrupper. Av disse egenskapene er fysiologisk betinget
tørketoleranse viktigst. Tørkeresistens, som mosene dels oppnår gjennom
vekstformer som reduserer fordamping og dels gjennom morfologiske særtrekk, vil
vi komme tilbake til nedenfor. For å forstå mosenes økologi, må vi starte med å
se på de fysiologiske forutsetningene for vekst og overlevelse.
Fysiologisk sett er
de fleste moser skyggeplanter, karakterisert ved lågt klorofyll a/b-forhold og
fotosyntesemaksimum ved låg strålingsintensitet. Oppbygging av organisk
materiale skjer ved C3-fotosynteseveien som hos de fleste andre
grønne planter. Moser er som gruppe tilpasset relativt kjølige habitater ved at
de har gjennomgående lågt temperaturoptimum for fotosyntesen (men
variasjonsbredden er stor).
Mosenes
tørketoleranse skyldes kombinasjonen av evne til å overleve kraftig uttørring
(ned til vanninnhold under 10% av tørrvekten) og poikilohydrisitet,
endring av vanninnhold med omgivelsene. Istedet for å visne når de blir tørre,
går mosene inn i en dvale-liknende, tørr tilstand. Vi kan dele mosene i to
hovedtyper etter vannhusholdning. Et lite mindretall er endohydriske. Bjørnemose,
Polytrichum, er en typiske
representant for disse. Endohydriske moser har et velutviklet indre
vannledningssystem, tar hovedsakelig opp vann fra jorda, og har morfologiske
tilpasninger til reduksjon av vanntapet (velutviklet kutikula, tjukke læraktige
blader, etc.). De aller fleste moser er imidlertid ektohydriske, og tar
opp vann og næringsstoffer gjennom hele overflata. Overganger mellom endo- og
ektohydriske moser (mixohydriske) finnes. Som vi har nevnt ovenfor, er
en sentral hypotese for bladmosenes utvikling at ektohydriske og poikilohydriske
moser har utviklet seg fra endohydriske moser. Hos bladmoser har dette skjedd
ved reduksjon av det indre vannledningssystemet og av bladnerven, hos
levermoser har dette skjedd ved overgang til en nedliggende vokseform og ved
reduksjon av den ventrale merofytten (bukbladene).
Både for endo- og
ektohydriske moser gjelder at når vanninnholdet synker under en viss nedre
grense stopper fotosyntesen og respirasjonen reduseres til et minimum;
moseplanten går i dvale. Først når mosen igjen fuktes opp, øker metabolismen på
nytt. Respirasjonen øker umiddelbart etter oppfukting, og stiger snart over
normalt mørkerespirasjonsnivå. Fotosyntesen trenger derimot lengre tid på å
komme igang; desto lengre uttørkingsperiode, jo lengre tid tar det før
fotosyntesens kompensasjonspunkt (det punktet der fotosyntese er lik
respirasjon) nås, og lågere blir derfor sannsynligheten for at mosen skal kunne
gjenopprette normal fotosynteseaktivitet. Blir uttørringsperioden for lang, dør
derfor moseplanten etter en (kort) periode med høg respirasjon. Det er
imidlertid stor variasjon mellom mosearter med hensyn til å tåle langvarig
uttørring. Moser har f.eks. kunne spire etter mange tiår i herbarium!
Poikilohydriske arter
har opportunistisk (miljøstyrt) vekst. For populasjoner av samme art vil
tilveksten derfor være relatert til total tid i oppfuktet tilstand, og
hyppighet og lengde av tørkeperioder. Disse parameterne styres både av lokale
og regionale (klimatiske) faktorer. På våre breddegrader har mange moser sine
mest aktive vekstperioder om våren og om høsten, når låge temperaturer
muliggjør lange perioder med sammenhengende fotosynteseaktivitet.
VEKSTFORMER HOS MOSER OG MOSERS HABITATØKOLOGI
Uttørringsresistens er
hos moser relatert til vekstform; det vil si hvordan enkeltskudd er organisert
i bestander i naturen. De viktigste vekstformer hos moser er (1) tepper
av tettstilte, opprette skudd (akrokarpe bladmoser, f.eks. Sphagnum torvmose), (2) puter av skudd
som vokser radiært ut fra et sentrum (f.eks. Orthotrichum bustehette), og (3) matter av nedliggende skudd
(bladete og thalloide levermoser, sammenvevninger av pleurokarpe bladmoser
(f.eks. Hylocomium splendens etasjemose). Enkeltskudd av
moser som vokser i tette tepper, puter eller matter tørker mye seinere ut enn
spredtstilte, enkeltstående skudd som f.eks. hos de endohydriske bjørnemosene.
Tettere pakking av enkeltskudd øker den kapillære vannlagringsevnen og
reduserer transpirasjonen fra hvert enkelt skudd. Ytterligere reduksjon av
traspirasjonen oppnås ved morfologiske tilpasninger, f.eks.
thallusdifferensieringen hos Marchantiales, skudd som er tiltrykt substratet,
trinne skudd med blad tiltrykt stengelen, papilløse blader, stengelfilt, etc.
Lågest tørketoleranse finner vi generelt innen Jungermanniales (tynne blad,
minimalt med støttevev).
Mosenes avhengighet
av vann og deres beskjedne størrelse begrenser hvilke økosystemer de kan
forekomme i. Moser forekommer sparsomt i tropiske, tørre områder, og har sitt
største mangfold i tempererte (og subarktiske), relativt fuktige strøk. Mosenes
forekomst i ulike typer av økosystemer bestemmes av flere faktorer. Moser kan i
lengden bare overleve på bakken (epigeisk
levevis) på steder der strøfallet ikke er større enn at et flertall av
moseskuddene kan vokse fram fra strøet i løpet av en vekstsesong. Moser mangler
derfor, eller er svært sparsomme, på bakken i tropisk lauvskog, og er også på
våre breddegrader gjennomgående mer sparsomme i edellauvskog enn i barskog fordi
nålestrøet er lettere for moser å takle enn lauvfallet. Moser er viktigst på
bakken i boreale barskoger, der de danner sammenhengende bestander som kan
utgjøre 1/3 av skogøkosystemets stående biomasse, og som har stor betydning for
systemets funksjon. Mosematta hindrer oppvarming av jorda om sommeren, hindrer
spiring av karplanters frø og reduserer frøplantenenes overlevelse. Moser er
også den dominerende plantegruppen i fuktig arktisk og antarktisk tundra, både
i biomasse og artsantall. En hoveddel av det karbon-reservoaret som ligger i
permafrostområder og torv som nå trues av global oppvarming består av frosne eller
vannmettete moserester.
Myrer, som først og
fremst finnes i den sirkumboreale sonen, er et økosystem dannet av moser, først
og fremst torvmoser, som er økologiske spesialister tilpasset liv i det
spesielle, sure og fuktige miljøet de sjøl skaper. Myrer utvikler seg i kjølig
klima med nedbøroverskudd, på steder som er lokalt fuktige med dårlig
utskiftning av vannet i jorda slik at det blir mangel på oksygen og
nedbrytningen av organisk materiale hemmes. Torvmoser er spesielt tilpasset å
vokse på slike steder. Torvmoseproduksjonen forbli
større enn nedbrytningen over tusener av år. Da akkumuleres torv, dødt organisk
materiale (først og fremst døde torvmoser) som bygger opp ei myr. Torvmosene er
poikilohydriske med evne til raskt å ta opp og lagre store mengder vann (inntil
tjue ganger tørrvekten) i hyalinceller og stengelhyalodermis, mellom taklagte
blader og tettstilte greiner. Tettstilte skudd (i matter) hindrer transpirasjon
og fremmer kapillært vannopptak fra substratet. Den store variasjonen mellom de
ca. 150 torvmoseartene (hvorav 45 i Norge) med hensyn til vokseform og
uttørringsresistens, er årsaken til at torvmoseartene fordeler seg langs en
gradient i avstand til grunnvannsspeilet i myra. Rusttorvmose (Sphagnum
fuscum), som vokser i myrtuer langt over grunnvannspeilet, har små, svært
tettstilte skudd som kan trekke opp vann kapillært fra et grunnvannsspeil
inntil 50 cm under moseoverflata. Fordi vokseformen reduserer fordampningen til
et minimum, holder rusttorvmosen seg fuktig lenge etter siste regnskyll. Arter
som vokser nærmere grunnvannspeilet har en løsere vokseform og vokser derfor raskere
når fuktighetstilgangen er god, men tørker også lettere ut.
Sammen med
uttørringstoleransen har poikilohydrisiteten gitt mosene mulighet til å tøye
grensene for sin forekomst i bakkevegetasjonen: mot små, mørke ’lommer’, mot tørre knauser
og åpne, steppe-liknende systemer, mot ekstreme snøleier til fjells, og mot
ustabile substrater. Mosene har også inntatt en rekke mikro-nisjer som er utilgjengelige
for andre landplanter, som er avhengig av et jordlag å feste røttene i, og å
trekke opp vann fra. En rekke moser finnes derfor på levende trestammer (epifyttisk
levevis), dødt trevirke (epixylt
levevis) eller mer eller mindre eksponert stein (saxicolt levevis),
også på stein i bekker og elver. En av de mest ekstreme nisjene moser vokser,
er på blader av eviggrønne lauvtrær i tropene (epifyllt levevis).
REPRODUKSJONSBIOLOGI
Fordelingen mellom
dioike (særbu) og monoike (sambu) arter er jevn blant bladmosene, mens ca. 75% av levermosene er dioike. Sporofytt forekommer hyppigere
hos monoike enn dioike taxa, og hos en del dioike arter er sporofytt aldri funnet!
Vellykket kjønnet reproduksjon hos dioike taxa er avhengig av et gunstig
lokalklima (p.g.a. spermatozoidoverføringens vannavhengighet) og av at
planter av forskjellig kjønn vokser nær hverandre.
Antallet sporer pr.
kapsel varierer med kapselstørrelse og sporestørrelse. Hos bladmoseslekta Archidium
finner vi ca. 16 store (inntil 200 Fm) sporer pr. kapsel,
levermoseslekta Riccia (Marchantiales) kan ha oppunder 200 sporer pr.
kapsel, mens det andre ytterpunktet utgjøres av levermoser (f.eks. Cephaloziella
i Jungermanniales) og bladmoser (f.eks. Dawsonia) med sporer ned mot 6-7
Fm i diameter, i et antall fra ca. 1 million (Scapania,
Jungermanniales) til ca. 75 millioner (Dawsonia) per kapsel.
De fleste bladmoser
er holoballister (’helplante-ristere’), det vil si at
sporene spres når hele moseplanten rister. En langlevet seta og et peristom som
beveger seg etter variasjoner i luftfuktigheten (åpner kapselen i tørt vær,
lukker den i fuktig vær), gjør at bladmosesporene spres porsjonsvis over en
lengre tid, i de periodene der muligheter for vellykket spredning er størst
(tørt vær med vind). Moser med lang, opprett kapsel og langt, sylindrisk
peristom er de mest utpregete holoballistene
blant mosene; en betydelig risting av moseplanten er nødvendig for at sporene
skal slippe ut av kapselen. Slike moser vokser gjerne i åpne, vindfylte
habitater. Kapseler uten peristom (gymnostome
kapsler) med redusert seta, eventuelt kapsler som ikke åpner seg i det hele
tatt (kleistokarpe), finner vi hos
moser med kort livssyklus i kortvarige, ustabile habitater, f.eks. i åker og på
periodevis oversvømte strender.
Noen mosegrupper har
utviklet helt spesielle spredningstilpasninger. Hos parasollmosene, Splachnum,
dyttes sporene i tørt vær ut av kapselåpningen, ned på den utvidete, klebrige nedre
delen av kapselen (apofysen). Åtsel- og møkkfluer tiltrekkes av dufter (og
trolig også apofysens farge; den kan være rødfiolett eller gul), får de
klebrige sporene på beina, og planter disse i det første og beste liket eller ruka
flua lander på. Epizoochori (’på-dyr-spredning’),
gjør at Splachnum med moderat reproduksjonsinnsats får spredd sporene
sine til pattedyrmøkk, det eneste substratet sporene kan spire i!
Plutselig
oppsprekking av kapselen og elaterenes hygroskopiske bevegelser bidrar til rask
sporespredning hos levermoser. Dette er viktig på grunn av den kortlevete
setaen. De aller fleste sporer og vegetative spredningsenheter faller ned nær
morplanten, men en betydelig langdistansespredning, f.eks. over is om vinteren,
kan også finne sted. Men det er bare et fåtall moser som ofte opptrer med
sporofytt, og for svært mange mosearter er derfor vegetative spredningsenheter
viktigste middel til å opprettholde populasjonsstørrelsen, i hvert fall på kort
sikt. Stort sett kan alle deler av en moseplante spire og gi opphav til en ny
gametofytt. Vi har tidligere vist eksempler på spesialiserte spredningsenheter,
gemmae, men i tillegg til disse
fungerer tilfeldig fragmenterte mosedeler som spredningsenheter hos alle
mosearter. Gemmae og gametofyttfragmenter spirer raskt når forholdene er
gunstige, mens det er uklart hvor ofte sporer spirer og gir opphav til en ny
gametofytt under naturlige forhold. Forsøk antyder at sporer kan være viktig
for populasjonsutviklingen hos en del arter i kortvarige/ustabile habitater,
men av helt underordnet betydning for arter med langlevet gametofytt under
normale, stabile forhold. For mange vanlige arter har det ennå ikke blitt
observert etablering fra sporer under feltforhold. Det betyr ikke at sporenes rolle
er ubetydelig. Spredt spiring fra sporer (både i tid og rom) kan ha stor
betydning for opprettholdelse av, og økning i, mosepopulasjonenes genetiske
variasjon.
LIVSHISTORIESTRATEGIER
Inndeling i
livshistoriestrategier (på grunnlag av forventet levealder, reproduksjonsinnsats,
regenerasjonsmåte, etc.) er et viktig redskap for å forstå evolusjonen i et økologisk
perspektiv. Evolusjonen innebærer løpende avveininger (eng. trade-offs) mellom egenskaper som
hver for seg fremmer overlevelse i neste generasjon, men som ikke lar seg
kombinere (f.eks. langlevethet og rask vekst; avkommets størrelse og antall; en
plantes reproduksjonsinnsats og dens dødsrisiko).
Den engelske økologen
Grime har foretatt en klassifisering av planteartene (opprinnelig basert på karplanter)
i tre hovedstrategier. Stress-tolerante (S-) arter har langt livsløp og
langlevete skudd (blader, stengler), er gjerne eviggrønne, har gjerne en
moderat reproduksjonsinnsats, er ofte klonale, har låg maksimal vekstrate, og
liten evne til rask respons på plutselig endrete økologiske forhold (nærings-
eller lystilgang). Ugunstige perioder overleves som herdige stengler og blad. Ruderale
(R-) arter har kort livsløp, reproduksjon (gjerne kjønnet) finner sted i en
kortvarig fase av livssyklus med høg produktivitet, maksimal vekstrate er høg,
responsen på endringer i miljøforholdene er rask. Ugunstige perioder overleves
som (dia)sporer. Konkurransekraftige (C-) arter (eng. competitors)
står i en mellomstilling eller viser stor variasjon med hensyn til livsløpslengde
og levetid for skudd-deler, de har gjerne regelmessig reproduksjon men låg
reproduksjonsinnsats. Den maksimale vekstraten er høg. Ugunstige perioder
overleves som vegetative organer (knopper) eller (dia)sporer. Grime mener at
plantepopulasjonenes livshistoriestrategi er resultatet av respons på og tilpasning
til den relative intensiteten av tre primære prosesser i vegetasjonen: konkurranse,
miljøstress og forstyrrelser (disturbances).
Grime mente
opprinnelig at moser stort sett plasserte seg mellom S og R i
livshistoriestrategi-trekanten der reine C-, S- og R-strategier plasseres i
hjørnene. Han begrunnet dette med at moser er små, eviggrønne og følsomme for
sterkt strøfall etc., slik at de spiller en underordnet rolle i habitater som er
optimale for konkurransekraftige karplanter. Nå mener de fleste at det også
blant moser finnes en betydelig variasjon i livshistoriestrategi, og at det
innenfor moser finnes en variasjonsbredde fra C til S til R-strateger.
Den nederlandske
økologen During har delt inn moser i seks livsstrategier på grunnlag av
enkeltskuddenes potensielle livslengde, deres spredningsevne (sporestørrelse;
spredningsevnen avtar raskt når sporestørrelsen overskrider 20 Fm) og
reproduksjonsinnsats. Han har også forsøkt å relatere livsstrategiene til
miljøforhold. Durings seks hovedstrategier kan ordnes langs en gradient fra
typisk ruderale arter med kort livslengde, høg reproduksjonsinnsats og tilhold
i kortvarige habitater (Durings fugitives og annual shuttle
species), til langlevete
arter med låg reproduksjonsinnsats og tilhold i langvarig stabile habitater (perennial
stayers og dominants). I en mellomstilling finner vi colonists
og perennial shuttle species,
arter med tilhold på substrater som har mellomlang, men likevel tidsavgrenset
varighet, slike som f.eks. trær og i åpninger (gaps) i ellers sluttet
vegetasjon. Gradienten fra fugitives/shuttle species til perennial
stayers/dominants svarer altså til en gradient fra R til S/C i
Grimes system.
Perennial stayers er trolig mosenes
mest opprinnelige livshistoriestrategi, med dominans av dioiki. Tilpasning til
kortvarige og/eller uforutsigbare habitater har skjedd ved forkorting av
livssyklus og kraftig økning i reproduksjonsinnsatsen: (1) ved overgang til
monoiki som muliggjør hyppigere befruktning og større sporeproduksjon, eller
(2) ved stor gemmaproduksjon. Det finnes få monoike arter med hyppig
gemmaproduksjon. Årsaken til dette kan være at det under evolusjonen har
forekommet perioder med sterk seleksjon for en type strategi, hvorved evnen til
videreutvikling av den andre har gått tapt.
Et stort hinder for
en dypere innsikt i mosenes livsstrategier er mangel på kunnskap om mosenes
populasjonsbiologi. Demografiske studier av moser vanskeliggjøres av mosenes
beskjedne størrelse og av at mosemattenes struktur lett forstyrres ved merking
og registrering. Studier med ringmerking av etasjemose Hylocomium splendens i skogbunnen i granskog i Norge gjennom en
femtenårsperiode har imidlertid vist at denne arten, som er en ektohydrisk perennial stayer som hovedsakelig
baserer seg på klonal vekst, har en populasjonsstruktur som i de fleste
henseende likner på den vi finner hos de klonale karplantene etasjemosen vokser
sammen med. Uten å påstå at etasjemosen er representativ for alle moser, vil vi
likevel trekke fram en del karakteristiske trekk ved denne artens
populasjonsbiologi.
De
populasjonsegenskapene som først og fremst bestemmer utviklingen i
etasjemosepopulasjonene, er hvor ofte skuddkjedene forgreiner seg (hvert nye vekstpunkt kan gi opphav
til en ny skuddkjede) og hvor ofte vekstpunkter dør. Vi kaller derfor disse
egenskapene for vitale rater. Dersom
antallet nye greiner er større enn antallet greiner som dør, vil populasjonen
over tid vokse; i motsatt fall vil den avta. Begge disse vitale ratene er
sterkt styrt av skuddstørrelsen. Store skudd har større motstandsdyktighet mot
ulike påvirkninger (f.eks. tørke) og generelt større vitalitet enn små skudd.
De greiner seg derfor oftere, og vekstpunkter på store skudd har mindre
sannsynlighet for å dø enn vekstpunkter på små skudd. Dermed vil etasjemosens
populasjonsdynamikk langt på vei bestemmes av de faktorene som styrer skuddenes
størrelse. Fordi mosen vokser når den er fuktig og er inaktiv når den er tørr,
er mikroklimatiske faktorer opplagt viktige. I tillegg vil voksestedsforhold
som topografi, jordfuktighet og lysforhold være viktige fordi de påvirker
lengden av mosens aktive vekstperiode. Nå er det også sånn at
etasjemosevekstpunktene ’subsidieres’ med vann og næringsstoffer fra
eldre deler av skuddet. Derfor vil et stort etasjemoseskudd gi opphav til nye
store etasjemoseskudd, og det vil ta tid før et lite eller skadet skudd vil
kunne utvikle seg til et stort skudd. Oppbygging av store skudd blir en langsom
prosess, og kontinuitet (stabilitet) blir derfor en av de egenskapene ved
miljøet som har størst betydning for populasjonsutviklingen.
I økologien har det
alltid vært sterkt fokus på konkurranse (gjensidig negativ påvirkning mellom
individer av samme eller forskjellige arter). Man skulle tro at konkurransen i
ei tett mosematte var sterk. Undersøkelser har imidlertid vist at det ikke er
så enkelt. Moser som vokser i tette matter holder bedre på fuktigheten enn
moser som vokser enkeltvis, og gjensidig positiv påvirkning (mutualisme) er derfor minst like
viktig. For etasjemosepopulasjoner i granskog er det påvist at gjennomsnittlig
skuddstørrelse øker når skuddtettheten øker. Likevel er det naturligvis ei
grense for hvor tette mosemattene kan bli. Tettheten reguleres på to måter. Når
tettheten øker, forgreiner skuddene seg sjeldnere på grunn av mindre lys
(utvikling av sidegreiner er lysavhengig). Dessuten øker sjansen for at små
enkeltskudd skal begraves i mosematta. Tettheten vil derfor bare øke inntil det
har inntruffet en balanse mellom avdøing og tilskudd av nye vekstpunkter. Begravingen i mosematta er ikke konkurranse i henhold til
definisjonen over (gjensidig negativ påvirkning), fordi en mose som vokser over
en annen mose ikke sjøl påvirkes av ’interaksjonen’.
Det er ennå ikke
publisert tilsvarende undersøkelser av andre mosearter, men det er god grunn
til å tro at populasjoner av andre ektohydriske, langlevete moser oppfører seg
på samme måte som etasjemose (med størrelsesavhengig vekst og mortalitet) fordi
moseartenes persistens (sannsynlighet for å overleve) i barskog øker med økende
skuddstørrelse. Når det gjelder moser med andre livshistoriestrategier, har vi
mindre kunnskap.
KILDER
Andersen, A.G.,
Boesen, D.F., Holmen, K., Jacobsen, N., Lewinski, J., Mogensen, G., Rasmussen,
K. & Rasmussen, L. 1976. Den danske mosflora. I. Bladmosser. - Gyldendal, København.
Andrus, R.E. 1980. Sphagnaceae (peat
moss family) of
Arnell, S. 1956. Illustrated moss flora of Fennoscandia.
I. Hepaticae. - Gleerup,
Bisang, I., Ehrlén, J. and Hedenäs, L. 2004. Mate limited reproductive success in two dioecious
mosses. - Oikos 104: 291-298.
Bopp, M. 1983. Developmental
physiology of bryophytes. - I: Schuster, R.M. (red.), New
manual of bryology, Hattori bot. Lab., Nichinan, s.
276-324.
Brotherus, V.F. 1924. Musci. III. Unterklasse Bryales.
II. Spezieller Teil. 1. - Nat. PflFamilien 10: 143-478.
Brotherus, V.F. 1925. Musci. III. Unterklasse Bryales.
II. Spezieller Teil. 1. - Nat. PflFamilien 11: 1-522.
Campbell, N.A. & Reece, J.B. 2002. Biology. Sixth
Ed. Pearson Education Inc.,
Clymo, R.S. & Hayward, P.M. 1982. The ecology of Sphagnum. -
I: Smith, A.J.E. (red.), Bryophyte ecology, Chapman & Hall,
Corley, M.F.V., Crundwell, A.C., Düll, R., Hill, M.O.
& Smith, A.J.E. 1981. Mosses of
Corley, M.F.V. & Crundwell, A.C. 1991. Additions and amendments to the
mosses of
During, H.J. 1979. Life strategies of bryophytes: a preliminary survey. - Lindbergia 5:
2-18.
During, H.J. 1990. Clonal growth patterns among bryophytes. - I: van Groenendael, J. &
de Kroon, H. (red.), Clonal growth in plants: regulation and function, SPB
Acad. Publ.,
During, H.J. 1992. Ecological classifications of bryophytes and lichens.
- I: Bates, J.W. & Farmer, A.M. (red.), Bryophytes and lichens in a changing
environment, Clarendon Press,
Edwards, S.R. 1984. Homologies and
inter-relationships of moss peristomes. - I: Schuster, R.M. (red.), New manual of bryology, Hattori bot. Lab., Nichinan, s.
658-695.
Flatberg, K.I. 1994. Norwegian Sphagna: a field colour
guide. - Univ.
Frisvoll, A.A.
& Blom, H.H. 1992. Trua moser i Norge med Svalbard; raud liste. - Norsk
Inst. Naturforsk. Utredn. 42: 1-55.
Frisvoll, A.A.,
Elvebakk, A., Flatberg, K.I., Halvorsen, R. & Skogen, A. 1984. Norske navn
på moser. - Polarflokken 8: 1-59.
Grime, J.P.,
Rincon, E.R. & Wickerson, B.E. 1990. Bryophytes and plant strategy theory. - Bot. J. Linn. Soc. 104: 175-186.
Grolle, R. 1983. Hepatics of
Harder, R. 1976. Bryophyta, liverworts and nosses. - I: von
Denffer, D., Schumacher, W., Mägdefrau, K. & Ehrendorfer, F. (red.),
Strasburger´s textbook of botany, ed. 30 (English version), Fisher,
Hébant, C. 1977. The conducting
tissues of bryophytes. - Bryophyt, Biblthca 10: 1-157.
Jia, Y., Wu, P.C., Wang M.Z. & He, S. 2003:
Takakiopsida, a unique taxon of bryophytes. -Acta. phytotax.
sin. 41: 350-361.
Longton, R.E. & Schuster, R.M. 1983. Reproductive biology. - I:
Schuster, R.M. (red.), New manual of bryology, Hattori
bot. Lab., Nichinan, s. 386-462.
Mischler, B.D. 1986. A Hennigian
approach to bryophyte phylogeny. - J. Bryol. 14: 71-81.
Mischler, B.D. & Churchill, S.P. 1984. A cladistic approach to the
phylogeny of the "bryophytes". - Brittonia 36: 406-424.
Nyholm, E. 1954-69. Illustrated moss flora of
Fennoscandia. II. Musci. - Gleerup, Lund & Swed. nat. Sci. Res. Coun.,
Proctor, M.C.F. 1990. The
physiological basis of bryophyte production. - Bot. J. Linn. Soc. 104:
61-77.
Renzgalia, S.R., McFarland, K.D. & Smith, D.K.
1997. Anatomy and ultrastructure of the
sporophyte of Takakia ceratophylla
(Bryophyta). Americ. J. Bot. 84: 1337-1350.
Ruhland, W. 1924. Musci. Allgemeiner Teil. - Nat.
PflFamilien 10: 1-100.
Rydgren,
K. & Økland, R.H. 2003. Short-term costs of sexual reproduction in the clonal
moss Hylocomium splendens. - Bryologist 106: 212-220.
Rydin, H. 1993. Mechanisms of interactions among
Sphagnum species along water-level gradients. - Adv. Bryol. 5: 153-185.
Schofield, W.B. & Hébant, C. 1984. The morphology and anatomy of the
moss gametophore. - I: Schuster, R.M. (red.), New
manual of bryology, Hattori bot. Lab., Nichinan, s. 627-657.
Schuster, R.M. 1966. The Hepaticae
and Anthocerotae of North America east of hundredth meridian.
Schuster, R.M. 1969. The Hepaticae
and Anthocerotae of North America east of hundredth meridian. II. -
Schuster, R.M. 1974. The Hepaticae
and Anthocerotae of North America east of hundredth meridian. III. -
Schuster, R.M. 1980. The Hepaticae and
Anthocerotae of North America east of hundredth meridian. IV. -
Schuster, R.M. 1983. Phytogeography
of the bryophyta. - I: Schuster, R.M. (red.), New
manual of bryology, Hattori bot. Lab., Nichinan, s. 463-626.
Schuster, R.M. 1984a. Comparative
anatomy and morphology of the Hepaticae. - I: Schuster, R.M. (red.), New manual og bryology, Hattori bot. Lab., Nichinan, s.
760-891.
Schuster, R.M. 1984b. Evolution,
phylogeny and classification of the Hepaticae. - I: Schuster, R.M.
(red.), New manual og bryology, Hattori bot. Lab.,
Nichinan, s. 892-1070.
Schuster, R.M. 1984c. Morphology, phylogeny and classification of the
Anthocerotae. - I: Schuster, R.M. (red.), New
manual og bryology, Hattori bot. Lab., Nichinan, s. 1071-1092.
Schuster, R.M. 1992a. The Hepaticae
and Anthocerotae of North America east of hundredth meridian. V. - Field Mus. nat. Hist.,
Schuster, R.M. 1992b. The Hepaticae
and Anthocerotae of North America east of hundredth meridian. VI. -
Field Mus. nat. Hist.,
Shaw, A.J. 1991. Ecological
genetics, evolutionary constraints, and the systematics of bryophytes. -
Adv. Bryol. 4: 29-74.
Shaw, A.J. 1992. The evolutionary
capacity of bryophytes and lichens. - I: Bates, J.W. & Farmer, A.W.
(red.), Bryophytes and lichens in a changing environment, Clarendon Press,
Shaw, A.J. 2000.Bryophyte biology.
Smith, A.J.E. 1978. The moss flora
of
Smith, A.J.E. 1990. The liverworts
of
Tamm, C.O. 1953. Growth, yield and nutrition in
carpets of a forest moss (Hylocomium splendens). - Meddn St. SkogsforskInst.
43: 1: 1-140.
Vitt, D.H. 1984. Classification of
the Bryopsida. - In: Schuster, R.M. (ed.), New
manual of bryology, Hattori bot. Lab., Nichinan, pp. 696-759.
Watson, E.V. 1969. British mosses
and liverworts, ed. 2. -
Watson, M.A. 1980. Patterns of
habitat occupation in mosses - relevance to considerations of the niche.
- Bull. Torrey bot. Club 107: 346-372.
Økland, R.H. 1995. Population biology of the clonal
moss Hylocomium splendens in Norwegian boreal spruce forests: demography. - J.
Ecol. 83: .697–712.
Økland, R.H. 2000. Population
biology of the clonal moss Hylocomium splendens in Norwegian boreal
spruce forests. 5. Vertical dynamics of individual shoot segments. -
Oikos 88: 449-469.
Økland, R.H.
& Økland, T. 1996. Population biology of the clonal moss Hylocomium splendens in Norwegian
boreal spruce forests. II. Effects of
density. - J. Ecol. 84: 63-69.